当前慢性阻塞性肺疾病的管理策略
概论
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是一种以持续性、进行性气流阻塞为特征的常见疾病。该疾病是吸入有害颗粒或气体后造成的慢性炎症反应加重的结果。COPD引起气道阻力增高和肺实质过度顺应性,从而导致呼气困难,空气潴留和过度充气。胸部力学改变,通气和气体交换的效率受到影响,最终结果往往是呼吸困难和运动能力下降。COPD的诊断需要肺活量测定有气道阻塞(气流受限)的证据。COPD的特征是第一秒用力呼气容积(FEV1,第一秒用力呼气量)与用力肺活量(FVC,用力呼气的总呼气量)的低固定比率。根据定义,这个比率必须低,通常小于70%[1]。
慢性支气管炎(慢性咳嗽和咳痰)和肺气肿(肺泡破坏)常被用作COPD的同义词。这些术语反映了COPD疾病状态的不同方面,并描述了共同的临床和影像特征。
COPD对全球死亡率的影响越来越大,目前是第三大死亡原因[2]。烟草的持续滥用(在中等收入国家日益增加)和人口老龄化是造成这一趋势的主要因素[1]。
多种环境暴露在COPD的疾病进展中发挥着作用,但到目前为止,吸烟是最主要的危险因素。世界卫生组织(World Health Organization,WHO)估计,2005年与吸烟相关的死亡人数约有540万人,并且预测,到2030年,这一数字将增加到每年830万。在低收入国家,由于使用生物燃料和通风不良造成的室内空气污染可能是一个与吸烟同样重要的危险因素[3]。其他危险因素包括职业暴露、遗传、年龄和反复感染。COPD的确切患病率尚不确定,因为其常被漏诊。20世纪70年代,美国男性吸烟率达到顶峰,目前在许多发达国家正在下降。然而,在许多欠发达国家女性吸烟率却仍在上升[4]。1980年至2000年间,美国女性死于COPD的人数几乎增加至三倍,相应地男性同期增加仅为13%[5]。60岁以下女性COPD发病率远高于男性,这是另一个值得警惕的趋势[6]。此外,女性生理上对烟草烟雾更易感[7]。在一些社会中,因为传统的性别角色,女性接触生物燃料暴露的机会往往更高(图1)。
由于合并症和高漏诊率,COPD的经济成本难以估计。仅在美国,2010年可归因于COPD的国家医疗费用估计为321亿美元。这一数据不包括生产力的损失,且预计到2020年将增加到490亿美元[8]。在欧盟,COPD的财政负担同样巨大[9],这可能只是保守估计[10]。
本文的目的是综述当前COPD的治疗策略,并简要概述未来的潜在趋势。
COPD的管理目标
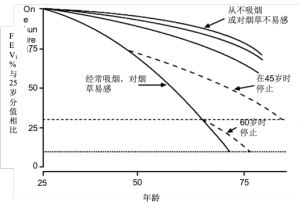
COPD是一种不可逆的慢性疾病。FEV1在生命早期就开始稳步下降。吸烟加速了这一过程。戒烟可使患者恢复到其自然年龄的预期衰退率,但已有的损害是永久的(图2)。早期和准确的诊断对减缓进一步恶化至关重要。识别个人危险因素非常重要,特别是吸烟。一旦诊断确定,其重点是消除危险因素。COPD一旦形成,极少有治疗方案会影响总体病死率。COPD治疗的首要目标是减缓进展和缓解症状。疾病的进展可以通过测定肺活量来监测。无论是从疾病进展还是生活质量的角度来看,预防急性加重和住院治疗是很重要的。COPD的发展轨迹呈阶梯型曲线,且急性加重经常导致肺功能下降。COPD慢性管理的其他重要内容是症状控制、早期癌症检测、改善功能和生活质量。
COPD最常见的症状是咳嗽(有或没有咳痰)和呼吸困难。主诉可能是持续性或间歇性的喘息。急性加重的定义是随着痰量增加或颜色改变而加剧的呼吸急促或咳嗽。据估计,COPD患者平均每年会有两到三次急性加重,老年患者和吸烟者会更多。急性加重是COPD高经济负担的重要因素,并使患者不堪重负。
肺癌在COPD中比在一般人群更常见[12],这并不奇怪,因为吸烟是这两种疾病的共同危险因素。
更重要的是,即使在控制吸烟后,COPD的存在似乎也是肺癌的独立危险因素[13,14]。鳞状细胞癌是COPD患者中最常见的类型[15]。除极少数情况外,手术切除是唯一可能治愈的方法。因此,早期识别可切除的肺肿瘤是现代COPD管理的一个重要组成部分。
不幸的是,即使做了所有的努力,许多患者仍会发展为终末期COPD,伴随呼吸衰竭或无法治愈的肺癌。临床医生应该准备好专注于临终关怀,并与患者讨论其与此相关的意愿。特别是,关于机械通气的讨论尤为必要[16]。一个常见的误解是只有当停止恢复治疗后才可以实施姑息治疗。事实上,早期的多学科姑息治疗措施可以提高肺癌患者的生存率[17]。
表1 概述了COPD管理的目标。

Full table
非药物干预措施
消除环境危险因素
根据定义,COPD是吸入有害物质的一种炎症反应。因此,消除暴露是预防COPD最重要的措施。特别是,戒烟已被反复证明可以降低发病率和全因死亡率[18]。有研究表明吸烟会加速与年龄相关的FEV1下降。戒烟后,曲线轨迹恢复到与年龄相关的预期下降率(图2)。
有几种尼古丁替代品可以帮助戒烟。尼古丁替代疗法,以长效尼古丁贴片和短效口香糖或含片的形式,显示可以提高50%~70%的戒烟率[19]。安非他酮,一种口服的抗抑郁药物,可将戒烟1年的成功率从12%提高到23%[20,21]。最近,伐尼克兰,一种a4b2神经元烟碱乙酰胆碱受体的选择性受体激动剂,取代了安非他酮成为更有效的选择。最初使用伐尼克兰治疗后成功持续戒烟的人比对照组多17%[22]。癫痫、抑郁、自杀和其他神经精神反应一直是安非他酮和伐尼克兰的传统问题。然而,最近一项对8000多例受试者进行的大型双盲研究未显示任何一种药物导致中度至重度神经精神不良反应显著增加[23]。美国监管机构已经取消了这两种药物的黑框警告,欧洲也采取了类似的措施。
在低收入地区,由于生物燃料是日常生活必需品,很难减少对它的暴露(图1)。关于通风和清洁能源有效性的教育可能会减少暴露[24]。
关于不同形式的心理治疗在戒烟中的效用,还没有明确的证据。有说法表示催眠有效,但一项Cochrane系统性综述并没有显示出任何明显的收益[25]。认知行为疗法是一种常见的辅助疗法,当与其他药物或非药物干预相结合时,可提高戒烟率,但其作为单一模式使用的数据很少。
其他一些技术作为辅助疗法也显示出了益处。戒烟热线可以为有意愿戒烟的患者提供可用资源以及在整个过程中提供情感支持。事实证明,当与其他传统工具结合使用时,这些辅助疗法是有效的[26]。同样的,已经证明专门的戒烟计划和诊所可以提高戒烟率[27]。
并发症或类似疾病的治疗
许多情况可能与COPD类似,如心脏病、支气管扩张和精神疾病。进行肺活量测定和明确的病史是确保合理治疗措施的必要条件。
接种疫苗
预防COPD急性加重和进一步的呼吸并发症非常重要,其中一种方法是及时地接种疫苗。流感是导致COPD急性加重、发病和死亡的常见可预防原因。每年接种流感疫苗可将流感相关急性呼吸道疾病的发病率降低76%[28]。COPD患者在流感季节的死亡率平均降低了40%[29]。在流感流行期间,患有肺部和心脏疾病的患者死亡率要高200倍[30]。接种肺炎球菌疫苗是降低肺炎球菌肺炎发病率的有效途径,它对COPD死亡率的影响尚不明确。美国疾病控制中心(The Centers for Disease Control, CDC)建议65岁时接种13价肺炎球菌结合疫苗(Pneumococcal conjugate vaccine, PCV),1年后再接种23价肺炎球菌多糖疫苗(Pneumococcal polysaccharide vaccine, PSV)。对于一部分65岁以下持续吸烟的COPD患者,可以考虑早期接种PSV。如果最后一剂次是在65岁[31]之前接种,则应在65岁或最后一次接种后5年(以较晚者为准)给予PSV加强剂。
肺康复
严重的呼吸困难往往限制COPD患者的运动能力。肺康复提供调节和呼吸技术以改善通气。重要的是,许多项目还包括对患者进行疾病进展的教育和心理支持,已证实康复治疗有许多好处。虽然死亡率收益仍有争议,但一直以来康复治疗被证明可以改善生活质量和运动能力,并减少呼吸困难[32]。据信,它还减少了住院天数和再次入院[33],从而减少了医疗资源的使用。
氧气疗法
氧疗是少数几种证实能有效降低特定COPD患者死亡率的治疗方法之一。静息血氧分压(pO2)≤55 mmHg [血氧饱和度(O2 sat)≤88%]或pO2在56 mmHg至59 mmHg之间并伴有红细胞增多症或肺源性心脏病时,提示需要辅助供氧。夜间氧疗试验(Nocturnal oxygen therapy trial,NOTT)表明,每天给氧至少15小时,一年死亡率降低8.7%,两年死亡率降低18.4%[34]。生活质量也将得到改善,但氧疗似乎对急性加重或住院率没有影响[35]。没有数据支持氧疗对单纯性夜间低氧血症有效[36]。最近的一项研究发现,对于中度静息性低氧血症(O2 sat 89%~93%)或运动性饱和度降低(O2 sat 80%~90%)的患者,氧疗没有益处[37]。
肺减容手术(Lung volume reduction surgery, LVRS)
按照标准选定的严重肺气肿患者可使用LVRS切除该双肺肺尖部分。该手术能改善弹性回缩,并减少过度充气。呼吸肌纤维可在长度-张力曲线上恢复到一个更良好的位置,进而改善呼吸力学。早期试验的死亡率降低不太理想。2003年,国家肺气肿治疗试验(The National Emphysema Treatment Trial, NETT)小组的一项试验对严重的原发性肺上叶肺气肿和康复后运动能力较差的患者显示了良好的结果,生活质量显著改善。此外,LVRS对实施组有良好的生存优势[38]。最近,一项旨在利用内窥镜手术实现类似收益的新技术正在开发。这些技术包括引入单向气道瓣膜,其可使过度充气的区域回缩。虽然能够观察到患者肺功能、运动耐量和症状有所改善,但却以更频繁的急性加重、肺炎和咯血为代价[39]。
药物治疗
支气管扩张剂是COPD药物治疗的主要药物。这些药物可降低气道肌张力,从而降低气道阻力和过度充气。支气管扩张通常是通过气道平滑肌细胞的表面受体完成。
β2肾上腺素受体激动剂
选择性β2受体激动剂是肾上腺素/去甲肾上腺素的衍生物,具有直接与气道平滑肌细胞的β2肾上腺素能受体结合的特性,刺激细胞内环磷酸腺苷(cyclic adenosine monophosphate, cAMP)的产生,使得肌肉松弛。常见的不良反应包括心动过速、震颤、焦虑和失眠。尚不清楚它们是否能引起更严重甚至致命的心律失常,但有一些研究提示有以上可能[40]。
吸入性短效β2受体激动剂(short-acting β2-agonist,SABA)与短效抗胆碱能药是治疗急性呼吸困难和喘息的主要药物。SABA起效时间数分钟,持续时间数小时,其常被用作治疗急性加重的抢救药物。当与短效抗胆碱药联合使用时,其疗效更显著[41]。按需给予短效支气管扩张剂的频率可用于对长期症状控制进行分级。吸入性短效支气管扩张剂可通过计量吸入器(metered dose inhaler,MDI)或雾化器(图3)给予。也有口服制剂,但不推荐常规使用,因为其不良反应研究不足。
长效β2受体激动剂(Long Acting β2-agonists,LABA),如沙美特罗和福莫特罗,优于短效治疗药物。有些制剂可在一小时内起效并持续12~24小时。LABA已被证明可以改善肺功能和生活质量,同时减少急性加重和住院率。应用沙美特罗治疗3年期间观察到FEV1下降速率比安慰剂组减少了13 mL/年(与氟替卡松联合使用时为16 mL/年)。这一微小改善的临床意义尚不明确[42]。当与吸入性糖皮质激素(inhaled corticosteroids,ICS)联合使用时,LABA的收益会增加。与用于支气管哮喘不同,LABA单独给药治疗不会增加死亡率,被认为是安全的。
抗胆碱能(抗毒蕈碱能)拮抗剂
短效(SAMA)和长效(LAMA)吸入制剂可供选择。抗胆碱能药物通过阻断乙酰胆碱对气道毒蕈碱受体的作用而起效,减少支气管收缩。副交感神经胆碱能活性被认为是COPD气道梗阻的主要可逆成分[43]。
异丙托溴铵是最常用的SAMA,起效时间为30~60分钟,持续时间为4-6小时。如果24小时不间断使用,每天需要使用四次。其效果持续时间比SABA更长[41]。有时其比SABA更受青睐,因为其对心肌的刺激更少,而且根据一些研究表明其更有效[44-46]。由于相对较长的起效时间,抗胆碱能拮抗剂不宜单独作为治疗急性加重的药物。
LAMA (噻托溴铵, 阿地溴铵, 乌美溴铵)每天可以仅用药一次或两次,起效时间与SAMA相似,但持续时间为12~24小时。研究显示LAMA可减轻症状和缓解急性加重。与沙美特罗相比,噻托溴铵显著减少了患者首次急性加重的天数[47],并改善了生活质量[48]。FEV1有微小但有显著性的改善(50-100 mL),但FEV1的下降率不受影响[49]。当与LABA结合使用时,LAMA的收益更大。LAMA对生存的影响尚不明确。一项大型随机研究表明,与对照组相比,中重度COPD患者服用噻托溴铵生存率更高,但死亡率是次要结果[50]。一项Cochrane系统性综述表明没有发现令人信服的提高生存率的证据[48]。抗胆碱能药物的不良反应包括口干、恶心、便秘和尿潴留。曾被认为会增加心血管死亡和中风的风险[51],前瞻性研究显示了良好的安全性,甚至降低了心脏发病率和死亡率[50]。对有青光眼或容易发生急性尿潴留(如前列腺肥大)的患者应用抗胆碱能药物时应谨慎。
糖皮质激素
气道炎症是COPD的一个突出特征[52]。抗炎药物如糖皮质激素已被广泛用于对症治疗和延缓疾病进展。
吸入糖皮质激素(inhaled corticosteroids, ICS)已被证实可以改善生活质量和症状,同时降低急性加重率[53]。其对FEV1下降率影响不大[54,55]。回顾性汇总数据表明,LABA对生存情况有益,当联合使用LABA时,这一点可能更加明显[56,57]。一项大型随机试验TORCH比较了吸入氟替卡松和沙美特罗单药和联合治疗的效果。尽管有良好的趋势,但该试验在3年后没有显示出统计学上显著的死亡率收益。然而,试验确实表明,ICS和LABA都适度减缓了FEV1下降,且改善了整体健康状况。联合用药比单独用药更有效。ICS已被证实比全身性类固醇具有更好的安全性,但肺炎发病率也有所增加[53,58]。一项大型队列研究表明,大剂量ICS使用者肺癌发病率降低[59],但该结果尚未得到对照试验的证实。关于骨质疏松症的发病率数据存在相互矛盾。ICS使用者口咽部念珠菌病和挫伤的发生率是对照组的两倍[54]。
全身性皮质类固醇(肠外或口服)通常用于急性加重期的短期使用。作为一种维持治疗,其应该只用于那些应用首选方案未能充分控制病情的患者。虽然其对减轻气道炎症有效,但高血压、高血糖、骨质疏松和神经精神症状等不良反应限制了其作为控制药物的应用。类固醇是治疗急性加重的主要药物。通常联合抗生素和雾化支气管扩张剂短期冲击使用。连续5天每天口服40毫克强的松且不减量,已被证明与较长疗程或更高剂量的疗程一样有效[60]。
磷酸二酯酶抑制剂
甲基黄嘌呤(茶碱)是非选择性磷酸二酯酶抑制剂。磷酸二酯酶的抑制提高了平滑肌细胞内cAMP的水平,导致支气管扩张。茶碱主要用作辅助剂,除了支气管扩张,还可以改善呼吸肌功能[61]。其使用受限于非常狭窄的治疗窗口和众多的药物相互作用,药物水平受年龄和肝功能的影响。浓度升高的不良反应包括心律失常、癫痫和胃肠道紊乱。茶碱的使用可能导致COPD患者更高的全因死亡率[62],不推荐作为一线治疗药物。
磷酸二酯酶-4 抑制剂是更有选择性的抑制剂,在不显著直接扩张支气管的同时可以减少炎症。罗氟司特被批准用于COPD频繁急性加重的患者[63]。当联合ICS和LAMA治疗时,可以看到FEV1的改善。最常见的不良反应包括恶心、腹痛和厌食导致的体重下降。
抗生素
除抗菌作用外,大环内酯类抗生素还具有免疫调节和抗炎特性[64]。易发生急性加重的COPD患者每日服用阿奇霉素可降低急性加重率并改善生活质量。长期使用可导致听力损害和Q-T间期延长[65]。
黏液溶解剂
粘液分泌增多在许多COPD患者中常见。黏液溶解剂对COPD治疗似乎是有用的。然而,支持常规使用黏液溶解剂的数据尚不足。N-乙酰半胱氨酸(N-acetylcysteine,NAC)是研究最多的黏液溶解剂,它对肺功能下降无影响,然而,它的使用可以使得急性加重有微小但显著地减少。对于频繁急性加重和住院的患者来说,收益可能更大[66]。未使用ICS的中度或重度COPD患者可以考虑使用黏液溶解剂,尤其是在冬季。目前其尚无统一使用剂量。
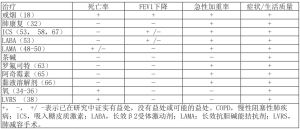
表2 总结了目前COPD最常见的治疗策略。
Full table
最新管理策略
随着我们对COPD的分子和细胞生物学的理解不断发展,新的治疗方案也在不断被发现。这些努力面临着一些挑战。COPD是一种异质性综合征,可能有不同的病因和病理机制[68]。需要努力识别表型并进行个性化治疗。建立一个可靠且可重复的动物模型非常困难,目前没有一种模型能够精确再现人体的变化[69]。COPD的发展是一个缓慢的过程,这就需要长期而昂贵的研究。确立可靠的早期标志物和评估COPD进展和治疗的有效性将是未来研究的重要一步[70]。
现有药物家族的新成员,如β受体激动剂、抗胆碱能药物和吸入性类固醇不断被开发[71]。与此同时,人们不断寻求新的方法。前列腺素通路正成为一个有前景的靶点,一些研究人员认为,影响前列腺素合成或信号传导是防止血管收缩、炎症和气道重塑的可行方法[72]。有研究提示基质金属蛋白酶的激活与COPD的病理生理学有关,特别是在急性加重期[73]。抑制这些酶的激活或合成可能是一个可行的治疗靶点[74]。整合素是一种在细胞与细胞之间以及细胞与基质的相互作用中发挥作用的跨膜蛋白。其在治疗气道炎症和气道重塑中的作用和潜力也是最近研究的治疗目标[75]。
抗白细胞介素-5注射剂是治疗顽固性嗜酸性哮喘的有效药物。目前进行中的试验正在评估这些药物在痰中嗜酸性粒细胞增多的COPD患者中的潜在作用[76]。
人们对开发新的戒烟治疗药物很感兴趣。阻断老鼠中枢神经系统中的大麻素受体可以逆转其条件反射性的尼古丁寻求行为[77]。人体数据令人鼓舞,但大麻素受体阻断剂的开发因其不良反应与精神障碍有关而被停止[78,79]。
开发针对滥用药物的疫苗是一个耐人寻味的概念,已经研究了多年[80]。虽然发明尼古丁疫苗的尝试目前仅限于动物实验,但结果是有希望的[81]。
总结
COPD是一种无法治愈的常见疾病。降低死亡率的治疗方法很少,治疗的主要目的是缓解症状和预防急性加重。COPD管理的主要策略是早期发现高危患者并减少危险因素,主要是吸烟。通过流行病学、细胞生物学和药理学方面的持续研究,更多的治疗方法将会不断出现。
Acknowledgments
Funding: None.
Footnote
Conflicts of Interest: Both authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/jphe.2017.02.02). The authors have no conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- From the Global Strategy for the Diagnosis, Management and Prevention of COPD. Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2017. Available from: http://goldcopd.org
- World Health Organization.The top 10 causes of death. Fact sheet N°310. 2013. Available online: http://www.who.int/mediacentre/factsheets/fs310/en
- Liu S, Zhou Y, Wang X, et al. Biomass fuels are the probable risk factor for chronic obstructive pulmonary disease in rural South China. Thorax 2007;62:889-97. [Crossref] [PubMed]
- Mackay J, Amos A. Women and tobacco. Respirology 2003;8:123-30. [Crossref] [PubMed]
- Mannino DM, Homa DM, Akinbami LJ, et al. Chronic obstructive pulmonary disease surveillance--United States, 1971-2000. MMWR Surveill Summ 2002;51:1-16. [PubMed]
- van Durme YM, Verhamme KM, Stijnen T, et al. Prevalence, incidence, and lifetime risk for the development of COPD in the elderly: the Rotterdam study. Chest 2009;135:368-77. [Crossref] [PubMed]
- Sørheim IC, Johannessen A, Gulsvik A, et al. Gender differences in COPD: are women more susceptible to smoking effects than men? Thorax 2010;65:480-5. [Crossref] [PubMed]
- Ford ES, Murphy LB, Khavjou O, et al. Total and state-specific medical and absenteeism costs of COPD among adults aged >/= 18 years in the United States for 2010 and projections through 2020. Chest 2015;147:31-45. [Crossref] [PubMed]
- The economic burden of lung disease. European Lung White Book. Available online: http://www.erswhitebook.org/chapters/the-economic-burden-of-lung-disease/, accessed January, 2017.
- Chapman KR, Mannino DM, Soriano JB, et al. Epidemiology and costs of chronic obstructive pulmonary disease. Eur Respir J 2006;27:188-207. [Crossref] [PubMed]
- Fletcher C, Peto R. The natural history of chronic airflow obstruction. Br Med J 1977;1:1645-8. [Crossref] [PubMed]
- Kiri VA, Soriano J, Visick G, et al. Recent trends in lung cancer and its association with COPD: an analysis using the UK GP Research Database. Prim Care Respir J 2010;19:57-61. [Crossref] [PubMed]
- Koshiol J, Rotunno M, Consonni D, et al. Chronic obstructive pulmonary disease and altered risk of lung cancer in a population-based case-control study. PLoS One 2009;4:e7380 [Crossref] [PubMed]
- Turner MC, Chen Y, Krewski D, et al. Chronic obstructive pulmonary disease is associated with lung cancer mortality in a prospective study of never smokers. Am J Respir Crit Care Med 2007;176:285-90. [Crossref] [PubMed]
- de Torres JP, Marin JM, Casanova C, et al. Lung cancer in patients with chronic obstructive pulmonary disease-- incidence and predicting factors. Am J Respir Crit Care Med 2011;184:913-9. [Crossref] [PubMed]
- Medarov BI. End stage pulmonary disease. Public Health Emerg 2016;1:2. [Crossref]
- Temel JS, Greer JA, Muzikansky A, et al. Early palliative care for patients with metastatic non-small-cell lung cancer. N Engl J Med 2010;363:733-42. [Crossref] [PubMed]
- Anthonisen NR, Skeans MA, Wise RA, et al. The effects of a smoking cessation intervention on 14.5-year mortality: a randomized clinical trial. Ann Intern Med 2005;142:233-9. [Crossref] [PubMed]
- Stead LF, Perera R, Bullen C, et al. Nicotine replacement therapy for smoking cessation. Cochrane Database Syst Rev 2012;11:CD000146 [PubMed]
- Ross S, Williams D. Bupropion: risks and benefits. Expert Opin Drug Saf 2005;4:995-1003. [Crossref] [PubMed]
- Hurt RD, Sachs DP, Glover ED, et al. A comparison of sustained-release bupropion and placebo for smoking cessation. N Engl J Med 1997;337:1195-202. [Crossref] [PubMed]
- Ebbert JO, Hughes JR, West RJ, et al. Effect of varenicline on smoking cessation through smoking reduction: a randomized clinical trial. JAMA 2015;313:687-94. [Crossref] [PubMed]
- Anthenelli RM, Benowitz NL, West R, et al. Neuropsychiatric safety and efficacy of varenicline, bupropion, and nicotine patch in smokers with and without psychiatric disorders (EAGLES): a double-blind, randomised, placebo-controlled clinical trial. Lancet 2016;387:2507-20. [Crossref] [PubMed]
- Fullerton DG, Bruce N, Gordon SB. Indoor air pollution from biomass fuel smoke is a major health concern in the developing world. Trans R Soc Trop Med Hyg 2008;102:843-51. [Crossref] [PubMed]
- Abbot NC, Stead LF, White AR, et al. Hypnotherapy for smoking cessation. Cochrane Database Syst Rev 2000;CD001008 [PubMed]
- Lichtenstein E, Zhu SH, Tedeschi GJ. Smoking cessation quitlines: an underrecognized intervention success story. Am Psychol 2010;65:252-61. [Crossref] [PubMed]
- Adelman WP, Duggan AK, Hauptman P, et al. Effectiveness of a high school smoking cessation program. Pediatrics 2001;107:E50 [Crossref] [PubMed]
- Wongsurakiat P, Maranetra KN, Wasi C, et al. Acute respiratory illness in patients with COPD and the effectiveness of influenza vaccination: a randomized controlled study. Chest 2004;125:2011-20. [Crossref] [PubMed]
- Schembri S, Morant S, Winter JH, et al. Influenza but not pneumococcal vaccination protects against all-cause mortality in patients with COPD. Thorax 2009;64:567-72. [Crossref] [PubMed]
- Barker WH, Mullooly JP. Pneumonia and influenza deaths during epidemics: implications for prevention. Arch Intern Med 1982;142:85-9. [Crossref] [PubMed]
- Kobayashi M, Bennett NM, Gierke R, et al. Intervals Between PCV13 and PPSV23 Vaccines: Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep 2015;64:944-7. [Crossref] [PubMed]
- McCarthy B, Casey D, Devane D, et al. Pulmonary rehabilitation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2015;CD003793 [PubMed]
- Man WD, Polkey MI, Donaldson N, et al. Community pulmonary rehabilitation after hospitalisation for acute exacerbations of chronic obstructive pulmonary disease: randomised controlled study. BMJ 2004;329:1209. [Crossref] [PubMed]
- Continuous or nocturnal oxygen therapy in hypoxemic chronic obstructive lung disease: a clinical trial. Nocturnal Oxygen Therapy Trial Group. Ann Intern Med 1980;93:391-8. [Crossref] [PubMed]
- Stoller JK, Panos RJ, Krachman S, et al. Oxygen therapy for patients with COPD: current evidence and the long-term oxygen treatment trial. Chest 2010;138:179-87. [Crossref] [PubMed]
- Cranston JM, Crockett AJ, Moss JR, et al. Domiciliary oxygen for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2005;CD001744 [PubMed]
- Long-Term Oxygen Treatment Trial Research Group. A Randomized Trial of Long-Term Oxygen for COPD with Moderate Desaturation. N Engl J Med 2016;375:1617-27. [Crossref] [PubMed]
- Fishman A, Martinez F, Naunheim K, et al. A randomized trial comparing lung-volume-reduction surgery with medical therapy for severe emphysema. N Engl J Med 2003;348:2059-73. [Crossref] [PubMed]
- Sciurba FC, Ernst A, Herth FJ, et al. A randomized study of endobronchial valves for advanced emphysema. N Engl J Med 2010;363:1233-44. [Crossref] [PubMed]
- Wilchesky M, Ernst P, Brophy JM, et al. Bronchodilator use and the risk of arrhythmia in COPD: part 2: reassessment in the larger Quebec cohort. Chest 2012;142:305-11. [Crossref] [PubMed]
- In chronic obstructive pulmonary disease, a combination of ipratropium and albuterol is more effective than either agent alone. An 85-day multicenter trial. COMBIVENT Inhalation Aerosol Study Group. Chest 1994;105:1411-9. [Crossref] [PubMed]
- Celli BR, Thomas NE, Anderson JA, et al. Effect of pharmacotherapy on rate of decline of lung function in chronic obstructive pulmonary disease: results from the TORCH study. Am J Respir Crit Care Med 2008;178:332-8. [Crossref] [PubMed]
- Gross NJ, Skorodin MS. Role of the parasympathetic system in airway obstruction due to emphysema. N Engl J Med 1984;311:421-5. [Crossref] [PubMed]
- Gross NJ. Ipratropium bromide. N Engl J Med 1988;319:486-94. [Crossref] [PubMed]
- Tashkin DP, Ashutosh K, Bleecker ER, et al. Comparison of the anticholinergic bronchodilator ipratropium bromide with metaproterenol in chronic obstructive pulmonary disease. A 90-day multi-center study. Am J Med 1986;81:81-90. [Crossref] [PubMed]
- Braun SR, McKenzie WN, Copeland C, et al. A comparison of the effect of ipratropium and albuterol in the treatment of chronic obstructive airway disease. Arch Intern Med 1989;149:544-7. [Crossref] [PubMed]
- Vogelmeier C, Hederer B, Glaab T, et al. Tiotropium versus salmeterol for the prevention of exacerbations of COPD. N Engl J Med 2011;364:1093-103. [Crossref] [PubMed]
- Karner C, Chong J, Poole P. Tiotropium versus placebo for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2014;CD009285 [PubMed]
- Tashkin DP, Celli B, Senn S, et al. A 4-year trial of tiotropium in chronic obstructive pulmonary disease. N Engl J Med 2008;359:1543-54. [Crossref] [PubMed]
- Celli B, Decramer M, Kesten S, et al. Mortality in the 4-year trial of tiotropium (UPLIFT) in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2009;180:948-55. [Crossref] [PubMed]
- Singh S, Loke YK, Furberg CD. Inhaled anticholinergics and risk of major adverse cardiovascular events in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. JAMA 2008;300:1439-50. [Crossref] [PubMed]
- Hogg JC, Chu F, Utokaparch S, et al. The nature of small-airway obstruction in chronic obstructive pulmonary disease. N Engl J Med 2004;350:2645-53. [Crossref] [PubMed]
- Calverley PM, Anderson JA, Celli B, et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007;356:775-89. [Crossref] [PubMed]
- Alsaeedi A, Sin DD, McAlister FA. The effects of inhaled corticosteroids in chronic obstructive pulmonary disease: a systematic review of randomized placebo-controlled trials. Am J Med 2002;113:59-65. [Crossref] [PubMed]
- Sutherland ER, Allmers H, Ayas NT, et al. Inhaled corticosteroids reduce the progression of airflow limitation in chronic obstructive pulmonary disease: a meta-analysis. Thorax 2003;58:937-41. [Crossref] [PubMed]
- Sin DD, Wu L, Anderson JA, et al. Inhaled corticosteroids and mortality in chronic obstructive pulmonary disease. Thorax 2005;60:992-7. [Crossref] [PubMed]
- Soriano JB, Vestbo J, Pride NB, et al. Survival in COPD patients after regular use of fluticasone propionate and salmeterol in general practice. Eur Respir J 2002;20:819-25. [Crossref] [PubMed]
- Drummond MB, Dasenbrook EC, Pitz MW, et al. Inhaled corticosteroids in patients with stable chronic obstructive pulmonary disease: a systematic review and meta-analysis. JAMA 2008;300:2407-16. [Crossref] [PubMed]
- Parimon T, Chien JW, Bryson CL, et al. Inhaled corticosteroids and risk of lung cancer among patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2007;175:712-9. [Crossref] [PubMed]
- Leuppi JD, Schuetz P, Bingisser R, et al. Short-term vs conventional glucocorticoid therapy in acute exacerbations of chronic obstructive pulmonary disease: the REDUCE randomized clinical trial. JAMA 2013;309:2223-31. [Crossref] [PubMed]
- Aubier M, Roussos C. Effect of theophylline on respiratory muscle function. Chest 1985;88:91S-97S. [Crossref] [PubMed]
- Horita N, Miyazawa N, Kojima R, et al. Chronic Use of Theophylline and Mortality in Chronic Obstructive Pulmonary Disease: A Meta-analysis. Arch Bronconeumol 2016;52:233-8. [PubMed]
- Martinez FJ, Calverley PM, Goehring UM, et al. Effect of roflumilast on exacerbations in patients with severe chronic obstructive pulmonary disease uncontrolled by combination therapy (REACT): a multicentre randomised controlled trial. Lancet 2015;385:857-66. [Crossref] [PubMed]
- Martinez FJ, Curtis JL, Albert R. Role of macrolide therapy in chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis 2008;3:331-50. [Crossref] [PubMed]
- Albert RK, Connett J, Bailey WC, et al. Azithromycin for prevention of exacerbations of COPD. N Engl J Med 2011;365:689-98. [Crossref] [PubMed]
- Poole P, Black PN. Mucolytic agents for chronic bronchitis or chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2010;CD001287 [PubMed]
- Yang IA, Clarke MS, Sim EH, et al. Inhaled corticosteroids for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2012;CD002991 [PubMed]
- Rennard SI. COPD heterogeneity: what this will mean in practice. Respir Care 2011;56:1181-7. [Crossref] [PubMed]
- Wright JL, Cosio M, Churg A. Animal models of chronic obstructive pulmonary disease. Am J Physiol Lung Cell Mol Physiol 2008;295:L1-15. [Crossref] [PubMed]
- Jones PW, Agusti AG. Outcomes and markers in the assessment of chronic obstructive pulmonary disease. Eur Respir J 2006;27:822-32. [Crossref] [PubMed]
- Devillier P, Garrigue E, D'Auzers G, et al. V0162 a new long-acting bronchodilator for treatment of chronic obstructive lung diseases: preclinical and clinical results. Respir Res 2015;16:68. [Crossref] [PubMed]
- Zaslona Z, Peters-Golden M. Prostanoids in Asthma and COPD: Actions, Dysregulation, and Therapeutic Opportunities. Chest 2015;148:1300-6. [Crossref] [PubMed]
- Papakonstantinou E, Karakiulakis G, Batzios S, et al. Acute exacerbations of COPD are associated with significant activation of matrix metalloproteinase 9 irrespectively of airway obstruction, emphysema and infection. Respir Res 2015;16:78. [Crossref] [PubMed]
- Daheshia M. Therapeutic inhibition of matrix metalloproteinases for the treatment of chronic obstructive pulmonary disease (COPD). Curr Med Res Opin 2005;21:587-94. [Crossref] [PubMed]
- Wright DB, Meurs H, Dekkers BG. Integrins: therapeutic targets in airway hyperresponsiveness and remodelling? Trends Pharmacol Sci 2014;35:567-74. [Crossref] [PubMed]
- Efficacy and Safety of Mepolizumab as an Add-on Treatment in Chronic Obstructive Pulmonary Disease (COPD). Available online: clinicaltrials.gov/ct2/show/NCT02105961, accessed January, 2017.
- Cohen C, Perrault G, Griebel G, et al. Nicotine-associated cues maintain nicotine-seeking behavior in rats several weeks after nicotine withdrawal: reversal by the cannabinoid (CB1) receptor antagonist, rimonabant (SR141716). Neuropsychopharmacology 2005;30:145-55. [Crossref] [PubMed]
- Steinberg MB, Foulds J. Rimonabant for treating tobacco dependence. Vasc Health Risk Manag 2007;3:307-11. [PubMed]
- Cahill K, Ussher MH. Cannabinoid type 1 receptor antagonists for smoking cessation. Cochrane Database Syst Rev 2011;CD005353 [PubMed]
- Kantak KM. Vaccines against drugs of abuse: a viable treatment option? Drugs 2003;63:341-52. [Crossref] [PubMed]
- Jacob NT, Lockner JW, Schlosburg JE, et al. Investigations of Enantiopure Nicotine Haptens Using an Adjuvanting Carrier in Anti-Nicotine Vaccine Development. J Med Chem 2016;59:2523-9. [Crossref] [PubMed]

项涛
成都市第三人民医院急诊科主任,西南交通大学硕士生导师,主任医师。1987年就读于重庆医科大学 临床医学专业;1992 年到成都市第三人民医院工作至今。先后在心血管,消化科,呼吸科,干部病房,肾脏病及内分泌科,神经内科,监护室,急诊科等科室工作。在长达近20余年的临床一线工作中,积累了丰富的临床经验,专业知识全面,扎实,过硬,对急诊常见病,多发病有着独特的见解,尤其擅长心脑血管,呼吸,消化系统等疾病的诊治,对急诊领域的各种危重病抢救,有着较深的造诣,对心肺复苏等各种急救技术能熟练应用,在院前急救,急诊科管理,危重病监护,急诊教学科研等方面也有深刻的见解,两次参加“5.12汶川大地震”“4.20芦山大地震”,并在“4.20芦山大地震”担任成都市第三人民医院医疗队队长,奔赴灾区一线抢险,并受到成都市卫生局及医管局的表彰,获得先进个人。(更新时间:2021/9/10)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Keen C, Medarov BI. Current strategies in chronic obstructive pulmonary disease management. J Public Health Emerg 2017;1:26.