HIV代谢门诊:始于英国,能否走向亚撒哈拉?
引言
近年来的统计数据显示,传染病的发病率和死亡率已发生大幅下降,尤其是HIV的感染发病和死亡情况已得到大大改善[1]。很大程度上,由于人们对HIV感染疾病的进程有了更加深入的理解,cART得到了有效的推广和使用[2]。MetS、脂肪肝、HIV 相关肾病 (HIV-associated Nephropathy, HIVAN)、心血管疾病(cardiovascular disease, CVD) 和内分泌失调等慢性非传染性疾病成为了全球重要公共卫生问题。慢性非传染性疾病对很多生活方式疾病的出现以及协同防治这些疾病有重要启示,是全球健康战略规划所面临的一个巨大挑战。如今,随着物质生活条件的改善,人们更偏好“垃圾食品”,生活方式趋向久坐不动,肥胖率愈来愈高,若不采取协调统一行为干预措施,MetS将对人们健康造成严重危害[1]。2003-2012 年美国国家健康和营养调查 (National Health and Nutrition Examination Survey, NHANES) 的普通人群调查数据显示,20~39岁年龄段人群的MetS患病率为18.3%,60岁及以上年龄段人群的患病率则高至46.7%。其中,女性患病率相对较高。尽管对HIV感染人群的调查结果尚存争议,但数据显示该人群MetS的患病率约为11.2%~45.4% [1,2]。
二十多年前,已有研究显示,HIV感染与MetS的发生发展有所联系。研究假设HIV感染引起的慢性低度炎症是导致并加剧易感个体肥胖的潜在原因[1,3],而使用特异性cART治疗,则会让HIV感染者MetS的发生发展机制变得更加复杂。cART药物会加剧HIV感染早期所产生的一些生理病理变化,这些病理变化进一步参与代谢组分的形成。例如,蛋白酶抑制剂 (protease inhibitors, PIs)(一类主要的 cART 药物)会对脂肪细胞的葡萄糖转运进行选择性抑制。然而,不治疗所带来的风险远大于cART药物引起的代谢紊乱风险[4]。
为解决这个问题,米尔顿凯恩斯大学医院(Milton Keynes University Hospital, MKUH) 开设了每周一次的代谢门诊。虽然该诊所刚刚设立,致力于持续发展满足患者需求,但迄今为止,代谢门诊已经满足了服务需求方相当一部分的医疗需求,具有很大的推广潜力和升值空间。在撒哈拉以南的非洲/亚撒哈拉地区(sub-Sahara Africa, SSA),艾滋病流行尤为严重,代谢门诊这种体系十分值得被采用推广。代谢门诊在管理复杂病例时大有裨益,可充分节约医疗成本,有效利用医疗资源。通过艾滋病专家和代谢研究团队的通力协作、交流并提供循证知识,可预防HIV感染者中常见的慢性非传染性疾病及相关严重并发症 [5]。
本文旨在研究包括MetS、DM、血脂异常、CVD、非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)、HIVAN和内分泌紊乱等HIV相关疾病的患病率、并发症、死亡率和卫生成本,探究为非洲的HIV感染者开设代谢门诊的必要性。
研究方法
文献确认
通过检索关键数据库,我们回顾了1996年至今发表的文献。由于cART从1996年开始推行,且世界卫生组织 (WHO)于1998年制订了第一个MetS标准[6,7],我们将最早的检索时间限制在1996年。我们全面检索了包括PubMed、Medline和Google Scholar在内的标准医学数据库。我们对“SSA”、“MetS患病率”和“HIV患病率”等相关医学主题词和自由词进行组合作为检索关键词,还使用了以下检索词:血脂异常、MetS、心血管风险、HIV、NAFLD、HIVAN、内分泌、甲状腺、肾上腺、钙、非洲代谢门诊和cART方案。此外,我们还通过回顾综述文献的参考文献,识别可纳入文献。
本文综述了包括 MetS、DM、血脂异常、CVD、NAFLD、HIVAN 和内分泌疾病等七种特定的HIV相关慢性非传染性疾病。
纳入研究的选择
通过独立审阅摘要和全文,我们纳入了相关文献。文献纳入标准包括:研究对象为非洲人群,接受cART治疗的HIV感染者,报告了不同HIV相关慢性疾病的患病及管理情况,以及在同行评审期刊上用英文发表。我们没有对样本量、研究方法或研究背景进行限制。如果在一篇文章中报告了多个调查结果,我们分别记录每项相关研究的调查结果。以下章节为纳入文献的研究结果。
在撒哈拉以南的非洲地区为HIV患者设立代谢门诊的必要性
HIV感染者糖尿病、高血压、NAFLD、HIVAN和内分泌失调的患病率居高不下,因此在以下章节中,我们将解释代谢紊乱的高患病率的原因,以及HIV代谢门诊所起的作用。
非洲HIV感染者与代谢综合征
MetS是一组复杂的CVD 和DM的危险因素相互关联的症候群。这些因素包括血糖异常、血压升高、甘油三酯升高、高密度脂蛋白降低以及肥胖(尤其是向心性肥胖)[5,8]。上世纪90年代中期以来,cART在HIV感染者中开始推广使用。AIDS和免疫缺陷相关临床事件发生率急剧下降,HIV感染者的预期寿命也有所增加[4]。由于cART被证明对心血管风险具有独立影响,因此,长期使用cART药物的HIV感染者个体不仅受药物影响,还和普通人群一样受DM和CVD等年龄相关疾病影响[8]。调查研究显示,人群中MetS十分常见,全球范围内的患病率正在不断增加。目前患病率为11.2%~45.4%,具体取决于调查抽样人群以及使用的MetS判断标准。尽管存在差异,但与未使用cART的HIV感染者相比,使用cART的HIV感染者的MetS患病率更高 [2]。
MetS并发症包括由心肌细胞毒性和内皮细胞凋亡所致的内皮功能障碍和血管损伤,同时伴有静息能量消耗增加、脂肪氧化和食物摄入增加等现象[1]。亚撒哈拉地区深受HIV流行影响,开设代谢门诊将大有裨益。亚撒哈拉地区的代谢门诊,可采用与英国MKUH代谢门诊相似的医疗模式。每一位前来就诊的HIV者感染可获得30 min的医疗服务,患者可在一般HIV门诊内与HIV专家、代谢专科医生及营养师,就MetS危险因素和生活方式等问题展开广泛讨论[5]。
非洲HIV感染者与糖尿病
DM是一种常见慢性病,全球范围内疾病负担日益增加。据估计,2030年全球成年人中将有4.39亿糖尿病患者,其中发展中国家新诊断的糖尿病患者将增加69%[9]。根据世卫组织的全球卫生观察站数据估计,全球全年龄段HIV感染者约3690万,亚撒哈拉地区的感染者人数最多,共2570万[10]。这更加突出了在医疗保健环境中,这两种慢性疾病所带来的巨大的全球负担。HIV感染者的治疗管理已得到极大改善,cART 的使用降低了疾病进展和患病率。然而,这也进一步导致诸如DM等慢性并发症和合并症的增加[11]。接受cART治疗的HIV患者所患有的许多代谢并发症中,就包括因葡萄糖和胰岛素代谢分子途径紊乱所致的胰岛素抵抗[12]。
尽管关于亚撒哈拉地区HIV感染者慢性病的研究数据很少,但仍有一些针对HIV感染等慢性病患者的研究[13]。这些研究显示,非洲 HIV感染者的血糖控制并不理想。目前,糖尿病患病率高低不等,因国家和收集的数据类型而异。一些非洲国家HIV糖尿病患者的患病率约2.1%~26.5%,葡萄糖耐受不良患病率20.2%~43.5%[14]。
另一项研究发现,HIV感染者DM患病率1%~26%,糖尿病前期患病率19%~47%。有研究报告了部分亚撒哈拉非洲国家HIV感染者DM患病率,其中尼日利亚2.3%、喀麦隆2%~26%、埃塞俄比亚6.4%、肯尼亚1.5%、坦桑尼亚0.7%~18%、卢旺达0.5% , 津巴布韦 0.8%~2.1%、南非 2.2%~17%[15]。
糖尿病的慢性并发症包括大血管病变和微血管病变。在一项针对马拉维普通糖尿病患者展开的研究发现,7.3%患有中风,6.7%有糖尿病足,结果与非洲其他地区的研究结果相似。该研究还探索了微血管病变并发症:与大血管病变并发症相比,微血管并发症发生率更高;其中34.7%患有肾病,34.7% 发生了视网膜病,46.4%发生了神经病变。在这项研究中,研究人员对患糖尿病的HIV感染者进行观察发现,白蛋白尿是唯一异常的生理指标,由于HIV会影响肾脏并导致HIVAN的发展,从而导致蛋白尿。值得注意的是,周围神经病变在DM和HIV感染中都十分常见。在马拉维进行的另一项研究发现,仅被诊断为HIV的患者也会出现周围神经病变。因此,在合并糖尿病和HIV的神经病变患者中,可能难以区分神经病变是由DM还是HIV引起的[16]。然而,非洲地区合并糖尿病和HIV的肾病患病率相关研究数据尚不充分。
非洲HIV患者与血脂异常
大多数研究发现,接受cART的HIV感染者者血脂异常十分常见,主要表现为总胆固醇升高、低密度脂蛋白(low-density lipoprotein cholesterol, LDL-c)升高、甘油三酯 (triglyceride, TG)升高以及高密度脂蛋白(high-density lipoprotein cholesterol, HDL- C)降低[14,17,18]。这些血脂异常与CD4+细胞计数水平呈正相关关系[17]。HIV慢性感染可引起急性期反应,并伴随脂蛋白脂肪酶活性的降低和后续TG增加。这些变化促进HDL转化和脂解,进而导致HDL-c 降低[19,20]。在发达国家, 心血管疾病风险评估对降低心血管疾病风险起到了至关重要的作用,因此非洲HIV感染者可受益于脂代谢专家的指导,让自身心血管疾病风险降低。根据Ntobeko Ntusi于2018年发表的一篇文献,南非是世界上接受cART治疗的HIV感染者人数最多的国家之一,且大部分患者也正在接受血脂异常治疗。戴夫等人2016年的研究显示,接受cART治疗的HIV感染者血脂异常患病率为85%,未接受cART治疗的感染者血脂异常患病率为 90%[17]。研究显示,HIV感染者高胆固醇血症患病率32.3%,LDL-c升高患病率9.5%,HDL-c降低患病率45.7%[14,17]。在其他非洲国家,血脂异常患病率较高。例如,肯尼亚HIV感染者血脂异常(包括TG、LDL-c和总胆固醇升高)患病率为63.1%;坦桑尼亚HIV 感染者TG升高患病率为28%,低 HDL-c降低患病率为67%,且这两种血脂异常还与低 CD4+ 计数有关(P<0.001)[10];尼日利亚的HIV感染者,TG升高、LDL-c升高和胆固醇升高的患病率则分别为35%、24% 和28% [21,22]。此外,喀麦隆、马拉维和埃塞俄比亚的血脂异常患病率分别为 70.2%、31%和56.9%[23-25]。
某些HIV治疗药物如蛋白酶抑制剂(PI)、核苷逆转录酶抑制剂 (NRTI) 和非核苷逆转录酶抑制剂(NNRTI)也可能导致血脂异常[5]。含有PIs的cART治疗方案可显著改善HIV感染者病毒学和免疫学状态,但可能增加HIV相关血脂异常风险,主要表现为TG增加、LDL-c增加、HDL-c降低以及Apo-C III和Apo-E的大量累积[5,26,27]。Dali Chen等人2002年的研究指出,接受cART治疗的HIV感染者血脂异常患病率约为70%~80%,血脂异常与PIs使用相关[18]。一些研究调查了cART治疗方案含PIs的HIV感染者,发现与一般人群相比,HIV感染者冠心病发病风险至少增加了三倍;PI相关的严重甘油三酯血症与急性胰腺炎发病风险增加相关[26,28-30]。其他治疗方案,如NRTIs,不仅与TG升高相关,cART药物的累积暴露还独立增加了26%的心肌梗塞 (myocardial infarction, MI) 发生率风险(P<0.001)。不过,D:A:D 队列研究[2008]同样指出,血脂异常只是导致MI发生率增加的原因之一 [31]。
血脂异常和免疫功能障碍之间的发病机制仍然有待探索[32]。不过,美国和尼日利亚的两项研究显示,血清LDL水平与CD4+细胞计数之间存在密切关联,血脂异常患病率随着CD4+细胞计数增加而增加[33,34]。随着HIV感染者寿命延长,诸如血脂异常、高血压和 CVD 等合并症风险也随之增加[35]。在亚撒哈拉的非洲国家,DM、血脂异常和MetS患病率很高,CVD已成为HIV感染者死亡的主要原因之一[14]。总之,血脂异常在很大程度上与CD4+细胞计数和cART药物有关,尤其是PIs。
非洲HIV感染者与心血管疾病
HIV感染者预期寿命的延长,伴随着许多代谢并发症出现,导致该人群心血管疾病CVD风险大大增加。值得注意的是,非洲国家HIV感染者的一个重要死亡原因就是CVD[14]。埃塞俄比亚一项研究发现,2005年以来,cART的使用让HIV及相关免疫缺陷所致死亡人数下降了70%。然而,鉴于cART使用增加了CVD风险,HIV感染仍是2015年埃塞俄比亚人口死亡的五大主要原因之一[36]。
HIV大流行的早期阶段,人们注意并记录了HIV感染中的心脏疾病[37]。cART治疗引入后,HIV感染成为一种慢性疾病,伴随着心血管疾病风险进一步增加[38]。在cART引进推广前后,CVD的疾病性质也存在差异。cART时代,发达国家的HIV 感染者中常见冠状动脉综合征、脂肪代谢障碍和MetS等心脏病。在亚撒哈拉非洲的发展中国家,心肌病、心包炎和肺动脉高压等疾病更为常见,这类疾病在前cART时代的发达国家的HIV感染者中更为普遍。这些合并症的差异可能源于发达国家医疗卫生基础设施更加完善。
“Heart of Soweto”是亚撒哈拉洲地区一项包含5328例研究对象的最大规模研究,致力于研究HIV与心脏疾病。研究发现,10%的CVD患者为HIV感染者。其中,37.8% 患HIV相关心肌病,12.5%有心包炎或心包积液,11.2%患心脏瓣膜病,7.1% 患高血压,6.9%患其他心脏病,6.6%患右心衰竭,6.2%患高血压性心力衰竭,2.7%有冠状动脉疾病。高血压和肥胖(CVD 的主要危险因素)在肯尼亚等国家的HIV感染者中也很常见[39]。位于布基诺法索的首都-瓦加杜古的国立医院展开了一项研究,有79例HIV感染者参与,研究调查了HIV 相关CVD的患病率:57%患有心肌病,32%患有心包炎,5%患有肺动脉高压,2例患有MI[40]。
大多数HIV相关心脏病都与死亡率增加有关。在发展中国家,人们发现HIV相关心肌病因为导致充血性心力衰竭而死亡率较高。此外,晚期HIV感染者患心包积液会使其死亡风险增加2.2倍[41]。在撒哈拉以南非洲地区,即使进行cART治疗,HIV相关的结核性心包炎的死亡率也高达20%~40%,这使得HIV感染者对这种可治愈疾病的医疗需求增加。布基诺法索的一项研究结果显示,HIV感染者合并心血管疾病的死亡率高达15%。
如上一节所述,亚撒哈拉地区的大部分研究和文献集中在CVD的感染相关和炎症相关病因。但众所周知,cART的使用不断增加、覆盖人口面积不断扩大、人口老龄化和城市化进程不断加快等因素,使得非洲HIV感染者退行性心脏病的患者数量不断增加。肯尼亚一项研究表明,尽管慢性非传染性疾病所导致的伤残调整生命年和总死亡率最高,但慢性非传染性疾病的预算分配(全球卫生和总体疾病负担的累计支出)最少[39]。尽管HIV感染者糖尿病和心血管疾病方面经济负担和疾病风险增加相关的数据有限,但刚果民主共和国一项研究发现,HIV感染者面临许多慢性疾病相关的问题,包括没钱支付交通费、没钱支付治疗费用以及遵循推荐的饮食,这些因素都进一步影响了HIV感染者对自身疾病的管理 [42]。cART改善了绝大多数HIV感染者的寿命,但也引起了许多并发症,而这些并发症都需要行之有效的管理措施。因此,一个完整的临床护理管理体系显得十分必要。
解决非传染性疾病(例如心血管疾病)和传染性疾病之间的显著共同存在的问题,需要扩展HIV项目计划。HIV感染者的代谢门诊不仅可以监测和治疗远期心血管并发症,防止疾病进展以及发病率和死亡率的进一步增加,还有助于识别和管理高血压、血脂异常和肥胖等心血管危险因素。
亚撒哈拉地区HIV感染者与非酒精性脂肪性肝病
尽管NAFLD的特征尚未得到全面描述和研究,但学者逐渐注意到并记录下HIV感染者中的NAFLD。越来越多证据表明,胰岛素抵抗和血脂异常等前驱因素,加上过度使用cART药物,可导致非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH),再进一步引起肝硬化[43]。值得注意的是,携带丙型肝炎病毒 (HCV) 的HIV感染者也可能患NAFLD[44,45];然而,无论是否感染HCV或乙型肝炎病毒 (HBV),正接受cART治疗的HIV感染者中有40%~60%会出现肝酶异常,远超过一般人群中8%的肝酶异常率[46]。
一项基于人群的研究发现,NAFLD的患病率为 26%;NAFLD与胰岛素抵抗和γ-谷氨酰转肽酶增加有关[46]。Sterling等人进行的一项有6000例HIV感染者的大型研究显示,未感染HCV的受试者中,AST和ALT异常的患病率分别为75%和55%。由于缺乏非肝炎病毒合并HIV感染者肝酶升高的研究证据,研究人员提出假设:cART药物肝毒性导致的脂肪性肝炎,然后引起肝酶升高[46]。Vernon等人的研究则进一步强调了在接受cART治疗的PLWHIV中NAFLD的患病率很高[47]。在尼日利亚进行的一项队列研究显示,113例长期进行ART治疗的HIV/AIDS患者中,13.3%有脂肪肝[21]。Olufunmilayo等人2009的研究提到, NAFLD患病率很高可能是病毒感染和其他机会性感染引起的肝脏肉芽肿反应[21]。如上所述,尽管NAFLD在文献中仍未得到很好的描述,但代谢门诊一定有益于NAFLD,因为代谢门诊不仅着眼于cART药物长期过度使用所带来的影响,而且还可以通过肝酶水平监测肝功能是否异常;此外,代谢门诊还可以通过更多研究来确定合并或不合并HCV感染的HIV感染者潜在的NAFLD危险因素和其他并发症。
亚撒哈拉地区HIV感染者与HIVAN
HIVAN在非洲HIV感染者中十分常见,常导致HIV感染者发生终末期肾功能衰竭[48]。由于cART 的使用和HIV感染者寿命的延长,撒哈拉以南非洲地区的3000万HIV感染者中HIVAN(几乎仅见于非洲裔)患病率可能很高[49]。微量白蛋白尿检测可作为HIVAN的早期筛查。对于持续存在微量白蛋白尿的感染者,需进一步进行肾活检,确认是否存在HIVAN。筛检有助于及早发现HIVAN,有助于HIVAN的早期治疗和疾病进展的防控。在大多数亚撒哈拉国家,由于卫生医疗资源有限、HIV疾病负担重,急性和慢性肾病无法得到及时检测,预防性治疗措施也未能及时开展。
不同国家的HIVAN的患病率差异很大,从4.7%到38%不等[50]。虽然研究报告了一些非洲国家的HIVAN流行率,包括南非(6%)、肯尼亚(25%)、尼日利亚(38%)、科特迪瓦 (26%)、乌干达 (20.0%~48.5%)、坦桑尼亚 (28%)、赞比亚 (33.5%)等,但尚缺乏研究来确定整个亚撒哈拉的HIVAN流行率[51]。此外,研究发现,HIVAN患者在诊断后几个月内便会进展至终末肾衰期[52]。数据显示,3.5%~12.0%(1~350万)非洲裔HIV感染者有HIVAN患病风险,这意味着SSA可能将面临肾功能衰竭的大流行,却无任何防控策略。HIVAN是20% HIV感染者发生急性肾功能衰竭的主要潜在原因。此外,20%的HIVAN患者也可能出现其他的急性肾功能异常。开普敦Groote Schuur医院数据显示,HIV感染者急性肾功能衰竭可由急性肾小管坏死(即败血症、肾毒性药物或低血容量性休克引起的急性肾损伤)、恶性高血压、药物相关的急性嗜酸性间质肾病或肾结核[53]引起。研究还表明,除HIVAN外, HIV感染者发生慢性肾功能衰竭的原因还包括HIV免疫复合物病、膜性肾小球肾炎、系膜毛细血管性肾小球肾炎、系膜增生性肾小球肾炎、局灶性节段性肾小球硬化、高血压肾硬化和糖尿病肾病等。
英国一项有20132例研究对象参与的研究表明,HIV感染者的基线肾功能降低会导致死亡率增加和肾病进展[54]。患者的估计肾小球滤过率(estimated glomerular filtrate rate, eGFR)越低,死亡风险越高。eGFR <30 mL/min的HIV感染者,死亡风险增加了3倍。该研究还发现,eGFR与种族之间的交互作用具有统计学意义(P<0.001),HIV感染的黑人eGFR 降低会显著增加他们的死亡风险。赞比亚另一项研究表明,肾功能不全的HIV感染者在开始ART治疗或治疗前90天的死亡风险显著增加[55]。这项研究也表明肾功能不全情况加重与死亡率增加有关。
非洲大陆由许多贫困的国家组成,这些情况影响了医疗保健的提供和临床决策的制订 [53]。世卫组织2012年对非洲国家的统计数据显示,45个非洲国家中,有41个的国家的人均国内生产总值低于8000美元,最低为246美元。这表明大多数国家无法满足每位患者平均每年肾脏替代治疗所需。根据2004年南非数据估计,血液透析需要大约9130美元,连续非卧床腹膜透析需要大约8319美元[53]。因此,在大多数非洲国家,感染HIV导致的晚期肾病在本质上就意味被判死刑。因此,在未发展成终末肾病需要肾脏替代治疗前,及时诊断、早期监测、及时治疗HIV相关肾病,有助于降低国家医疗费用,有助于降低HIV感染者因无法负担治疗费用而造成的死亡风险。
我们正走向一个HIV感染者肾功能衰竭流行的时代,因此,在非洲开设代谢门诊可以定期监测HIV感染者肾功能,并在肾损伤早期提供适当治疗、控制肾功能进展。
撒哈拉沙漠以南非洲地区HIV感染者与内分泌紊乱
众所周知,HIV会导致内分泌系统及相关器官功能异常。然而,在过去的二十年,cART 的普及进一步导致HIV感染者内分泌疾病的发生率升高。内分泌系统与HIV之间关联十分复杂,相关方面的医学研究正在不断发展[56]。内分泌系统控制着全身许多功能,但在本综述中,我们仅针对钙调节、甲状腺和肾上腺功能进行阐述。肾上腺是内分泌系统中最可能受HIV感染影响的腺体,因此识别肾上腺功能不全等并发症十分重要。肾上腺功能不全患病率大差异很大,约为0.5%~72%。导致HIV患者肾上腺功能不全的一个潜在原因是巨细胞病毒 (CMV) 感染,然而,其他诸如隐球菌病、胞内鸟分枝杆菌、弓形体病、卡氏肺孢子菌病、组织胞浆菌病和芽生菌病等机会性感染也会导致肾上腺功能不全。
南非一项有66例HIV感染者参与的横断面研究发现,肾上腺功能减退症的患病率为 27%,研究对象中也存在上文提及的机会性感染。研究发现,队列所有研究对象均感染了CMV,68.2%感染了结核病[57]。在一项有43例尼日利亚的HIV感染者参与的研究发现,肾上腺功能不全患病率为34.8%,由于该研究根据检测结果的临界值判断肾上腺功能不全,因此可能低估实际肾上腺功能不全患病率。此外,因为该研究中的研究对象均未接受过ART治疗,因此无法评价ART治疗对HIV和肾上腺功能不全的影响[58]。塞内加尔一项研究对接受ART治疗的HIV感染者进行调查研究发现,与未感染HIV的对照组相比,HIV感染者常见并发症是身体体质指数(body mass index, BMI)降低;此外,定量超声 (quantitative ultrasound, QUS)结果显示HIV感染者骨矿物质密度降低,可能与其较低的BMI相关,但尚未发现ART与QUS骨矿物质密度降低之间存在显著相关 [59]。
在一项针对尼日利亚绝经前妇女甲状腺功能障碍对生殖激素影响的研究中,研究发现有症状的HIV感染者在月经周期的卵泡期和黄体期的卵泡刺激素(follicle-stimulating hormone, FSH)、促黄体生成素(luteinizing hormone, LH)、黄体酮和雌二醇之间没有显著差异,然而,在健康组中,四种激素在两个阶段均存在显著差异。因此,HIV感染者缺乏正常生理周期可能导致生殖功能障碍。研究发现,黄体期黄体酮水平降低可能会影响怀孕并可能导致自然流产,而上述激素的进一步减少也可能导致月经问题,如月经不调[60]。
一项来自乌干达的研究对感染了HIV且就诊于急诊科的危重患者进行了研究,主要关注研究对象功能性肾上腺功能不全(FAI),并简要讨论了研究对象的死亡率。该研究包括113例患者,但只有21例诊断为FAI。研究中,每组之间死亡率无显着差异:FAI组死亡率19%(4例),肾上腺功能正常的对照组死亡率为33%(30例)。与出院患者相比,死亡患者的平均皮质醇水平更高。研究表明,皮质醇水平较高的患者可能预后较差。
不过,21例FAI患者样本量太小,很难明确死亡原因。研究显示,接受肾上腺皮质激素治疗的FAI患者均存活,而未接受治疗的FAI患者中有30%在医院死亡。研究结果突出了肾上腺皮质激素治疗FAI的潜在意义,但尚需进一步探究[61]。
目前对HIV感染者合并内分泌疾病死亡率的研究很少,因此,开展更深入的研究,理解该人群的临床价值和全面掌握其死亡率显得十分重要。一篇论文研究了南非469例感染HIV的住院患者的护理费用。研究中,只有一例内分泌和代谢异常的HIV感染者入院,住院费用2472美元,其中大部分费用来自医务人员,为1063美元,固定费用包括空间、设备使用费和酒店费用,总计905美元 [62]。
如今,需要针对内分泌紊乱病理过程、内分泌紊乱如何受HIV感染影响及相应治疗方案等议题进行更多的研究。此外,需要更多地了解非洲HIV感染人群内分泌紊乱的长期并发症和死亡风险,这将有助于快速发现和更好地管理内分泌疾病。
HIV代谢门诊的潜在益处
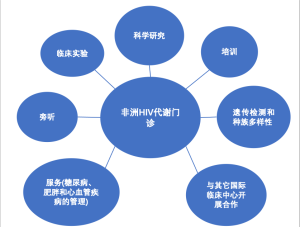
如前所述,HIV最初被认为是一种致命的疾病,尤其在发展中国家。然而,治疗方法的进步使HIV感染成为了一种慢性病。目前,HIV感染者死于机会性感染的几率较低,取而代之的是MetS和其他慢性病的出现 [1]。因此,开设一个配备专家的代谢门诊来解决这个问题大有裨益且必不可少。设立代谢专科门诊不仅可以确保全世界的HIV感染者拥有更好的生活质量,而且可以预防MetS和其他长期慢性疾病相关并发症[4,5]。长远来看,亚撒哈拉非洲国家可节省医疗费用和卫生资源,从而大大减轻其医疗卫生系统负担。节省的医疗费用可以用于其他资金匮乏的医疗保健领域,从而以更具成本效益,更有效率的方式利用现存资源和费用[2]。同样,由于可以在HIV临床门诊中提供额外的代谢疾病相关医疗服务,HIV临床医生严格遵守保密原则为患者提供无缝衔接的服务,HIV感染者会感到更加自在,前来就诊以及执行医嘱的依从性更好。此外,应当制订HIV合并多种慢性疾病的指南,建立代谢数据库,用于进一步研究、审核和教学。代谢门诊将为所有专科医生创建一个可以进行有效沟通的平台,这意味着患者每次就诊时都会得到一个多学科诊疗临床决策,该决策不仅包括慢性非传染性相关疾病风险评估,还包括如何管理HIV病情和ART药物使用[5]。更多有关代谢门诊的潜在益处,请参见图1。
结论
大量数据表明,cART药物的使用延长了HIV感染者寿命,因此在HIV感染者中也存在一般人群常见的年龄相关疾病风险。重要的是,这些药物可能导致代谢综合征(DM、肥胖、血脂异常、HIVAN、NAFLD)以及心血管疾病的患病风险增加。在非洲国家,HIV感染者高死亡率的原因很多,其中最重要的心血管疾病,这可能与MetS疾病风险增加有关;还有一部分则归因于 CVD。CVD也是疾病发病风险的重要因素。降低疾病风险、改变生活方式在这些患者的管理中起着至关重要的作用。因此,引入代谢门诊不仅能够满足患者临床服务需求,还能保证cART 药物的谨慎选择,使具有心血管危险因素的HIV感染者患CVD风险降低。此外,代谢门诊也将为未来的数据收集和研究提供进一步的基础(图1)。
Acknowledgments
Dr. Mital and Dr. Ahmed would like to thank all the staff in the department of HIV and Blood Borne Viruses, Milton Keynes University Hospital, NHS Foundation Trust, Milton Keynes, UK for their support for HIV metabolic clinic.
Funding: None.
Footnote
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/jphe.2018.09.02). MHA serves as an unpaid editorial board member of Journal of Public Health and Emergency from August 2017 to July 2019. The other authors have no conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Abhijit S. A Metabolic Syndrome and HIV infection. J HIV Retro 2016;2:1.
- Obirikorang C, Quaye L, Osei-Yeboah J, et al. Prevelance of Metabolic syndrome among HIV infected patients in Ghana: A cross sectional study. Niger Med J 2016;57:86-90. [Crossref] [PubMed]
- Brian R, Andrew B, James H. Strengthening Routine data systems to track the HIV epidemic and guide the response in sub saharan Africa. JMIR Public health Surveil 2018;4:e36.
- Paula AA, Falcao MC, Pacheo AG. Metabolic syndrome in HIV-infected individuals:underlying mechanisms and epidemiological aspects. AIDS Res Ther 2013;10:32. [Crossref] [PubMed]
- Ahmed MH, Woodward C, Mital D. Metabolic clinic for individuals with HIV/AIDS: a commitment and vision to the future of HIV services. Cardiovasc Endocrinol 2017;6:109-12. [Crossref]
- New therapies: new hope. Reports from the International Nursing Satellite symposium and the Eleventh International Conference on AIDS, Vancouver, Canada, 6-12 July, 1996. Midwifery 1996;12:205-6. [Crossref] [PubMed]
- Alberti KG, Zimmet PZ. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: diagnosis and classification of diabetes mellitus provisional report of a WHO consultation. Diabet Med 1998;15:539-53. [Crossref] [PubMed]
- Alberti KG, Eckel RH, Grundy SM, et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation 2009;120:1640-5. [Crossref] [PubMed]
- Shaw JE, Sicree RA, Zimmet PZ. Global estimates of the prevalence of diabetes for 2010 and 2030. Diabetes Res Clin Pract 2010;87:4-14. [Crossref] [PubMed]
- GHO | By category | Number of people (all ages) living with HIV - Estimates by WHO region. Available online: http://apps.who.int/gho/data/view.main.22100WHO?lang=en
- Kalra S, Kalra B, Agrawal N, et al. Understanding diabetes in patients with HIV/AIDS. Diabetol Metab Syndr 2011;3:2. [Crossref] [PubMed]
- Samaras K, Wand H, Law M, et al. Prevalence of metabolic syndrome in HIV-infected patients receiving highly active antiretroviral therapy using International Diabetes Foundation and Adult Treatment Panel III criteria: associations with insulin resistance, disturbed body fat compartmentalization, elevated C-reactive protein, and [corrected] hypoadiponectinemia. Diabetes Care 2007;30:113-9. [Crossref] [PubMed]
- Mugisha JO, Schatz EJ, Randell M, et al. Chronic disease, risk factors and disability in adults aged 50 and above living with and without HIV: findings from the Wellbeing of Older People Study in Uganda. Glob Health Action 2016;9:31098. [Crossref] [PubMed]
- Husain NE, Noor SK, Elmadhoun WM, et al. Diabetes, metabolic syndrome and dyslipidemia in people living with HIV in Africa: re-emerging challenges not to be forgotten. HIV AIDS (Auckl) 2017;9:193-202. [Crossref] [PubMed]
- Njuguna B, Kiplagat J, Bloomfield GS, et al. Prevalence, Risk Factors, and Pathophysiology of Dysglycemia among People Living with HIV in Sub-Saharan Africa. J Diabetes Res 2018;2018:6916497 [Crossref] [PubMed]
- Cohen DB, Allain TJ, Glover S, et al. A survey of the management, control, and complications of diabetes mellitus in patients attending a diabetes clinic in Blantyre, Malawi, an area of high HIV prevalence. Am J Trop Med Hyg 2010;83:575-81. [Crossref] [PubMed]
- Dave JA, Levitt NS, Ross IL, et al. Antiretroviral therapy increases the prevalence of dyslipidaemia in South African HIV-infected patients. PLoS One 2016;11:e0151911 [Crossref] [PubMed]
- Chen D, Misra A. Lipodystrophy in human immunodeficiency virus-infected patients. J Clin Endocrinol Metab 2002;87:4845-56. [Crossref] [PubMed]
- van der Westhuyzen DR, de Beer FC, Webb NR. HDL cholesterol transport during inflammation. Curr Opin Lipidol 2007;18:147-51. [Crossref] [PubMed]
- van der Voort PH, Gerritsen RT, Bakker AJ, et al. HDL-cholesterol level and cortisol response to synacthen in critically ill patients. Intensive Care Med 2003;29:2199-203. [Crossref] [PubMed]
- Lesi OA, Soyebi KS, Eboh CN. Fatty liver and hyperlipidemia in a cohort of HIV-positive Africans on highly active antiretroviral therapy. J Natl Med Assoc 2009;101:151-5. [Crossref] [PubMed]
- Salami AK, Akande AA, Olokoba AB. Serum lipids and glucose abnor- malities in HIV/AIDS patients on antiretroviral therapies. West Afr J Med 2009;28:10-5. [Crossref] [PubMed]
- Armstrong C, Liu E, Okuma J, et al. Dyslipidemia in an HIV-positive antiretroviral treatment-naive population in Dar es Salaam, Tanzania. J Acquir Immune Defic Syndr 2011;57:141-5. [Crossref] [PubMed]
- Bekolo CE, Nguena MB, Ewane L, et al. The lipid profile of HIV-infected patients receiving antiretroviral therapy in a rural Cameroonian population. BMC Public Health 2014;14:236. [Crossref] [PubMed]
- Feleke Y, Fekade D, Mezegebu Y. Prevalence of highly active antiret- roviral therapy associated metabolic abnormalities and lipodystrophy in HIV infected patients. Ethiop Med J 2012;50:221-30. [PubMed]
- Bittar R, Giral P, Aslangul E, et al. Determinants of low-density lipoprotein particle diameter during antiretroviral therapy including protease inhibitors in HIV-1-infected patients. Antivir Ther 2012;17:855-60. [Crossref] [PubMed]
- Fauvel J, Bonnet E, Ruidavets JB, et al. An interaction between apo C-III variants and protease inhibitors contributes to high triglyceride/low HDL levels in treated HIV patients. AIDS 2001;15:2397-406. [Crossref] [PubMed]
- Lang S, Mary-Krause M, Cotte L, et al. Increased risk of myocardial infarction in HIV-infected patients in France, relative to the general population. AIDS 2010;24:1228-30. [Crossref] [PubMed]
- Lang S, Mary-Krause M, Cotte L, et al. Impact of individual antiretroviral drugs on the risk of myocardial infarction in human immunodeficiency virus-infected patients: a case- control study nested within the French Hospital Database on HIV ANRS cohort CO4. Arch Intern Med 2010;170:1228-38. [Crossref] [PubMed]
- Sullivan AK, Feher MD, Nelson MR, et al. Marked hypertriglyceridaemia associated with ritonavir therapy. AIDS 1998;12:1393-4. [Crossref] [PubMed]
- Sabin CA, Worm SW, Weber R, et al. Use of nucleoside reverse transcriptase inhibitors and risk of myocardial infarction in HIV-infected patients enrolled in the D:A:D study: a multi-cohort collaboration. Lancet 2008;371:1417-26. [Crossref] [PubMed]
- Armstrong C, Liu E, Grinspoon S, et al. Dyslipidemia in an HIV-positive, antiretroviral treatment-naïve population in Dar es Salaam, Tanzania. J Acquir Immune Defic Syndr 2011;57:141-5. [Crossref] [PubMed]
- Anyabolu EN. Dyslipidemia in people living with HIV-AIDS in a tertiary hospital in South-East Nigeria. Pan Afr Med J 2017;28:204. [Crossref] [PubMed]
- Floris-Moore M, Howard AA, Lo Y, et al. Increased serum lipids are associated with higher CD4 lymphocyte count in HIV-infected women. HIV Med 2006;7:421-30. [Crossref] [PubMed]
- Menezes de Pádua CA, Moura CS. Availability of data on adverse reactions to antiretroviral drugs in medical charts according to the naranjo algorithm: an example of a Brazilian historical cohort. Clin Drug Investig 2014;34:395-402. [Crossref] [PubMed]
- Misganaw A, Haregu TN, Deribe K, et al. National mortality burden due to communicable, non-communicable, and other diseases in Ethiopia, 1990-2015: findings from the Global Burden of Disease Study 2015. Popul Health Metr 2017;15:29. [Crossref] [PubMed]
- Syed F, Sani, M. Recent advances in HIV-associated cardiovascular diseases in Africa. [online] British Medical Journal. Available online: https://heart-bmj-com.rsm.idm.oclc.org/content/99/16/1146
- Bloomfield GS, Khazanie P, Morris A, et al. HIV and Noncommunicable Cardiovascular and Pulmonary Diseases in Low- and Middle-Income Countries in the ART Era. J Acquir Immune Defic Syndr 2014;67:S40-53. [Crossref] [PubMed]
- Bloomfield G, Hogan J, Keter A, et al. Hypertension and Obesity as Cardiovascular Risk Factors among HIV Seropositive Patients in Western Kenya. PLoS One 2011;6:e22288 [Crossref] [PubMed]
- Niakara A, Drabo Y, Kambire Y, et al. Cardiovascular diseases and HIV infection: study of 79 cases at the National Hospital of Ouagadougou (Burkina Faso). Bull Soc Pathol Exot 2002;95:23-6. [PubMed]
- Ntsekhe M, Hakim J. Impact of Human Immunodeficiency Virus Infection on Cardiovascular Disease in Africa. Circulation 2005;112:3602-7. [Crossref] [PubMed]
- Murphy A, Biringanine M, Roberts B, et al. Diabetes care in a complex humanitarian emergency setting: a qualitative evaluation. BMC Health Serv Res 2017;17:431. [Crossref] [PubMed]
- Ahmed MH, Husain NE, Almobarak AO. Nonalcoholic Fatty Liver Disease and Risk of Diabetes and Cardiovascular Disease: What Is Important for Primary Care Physicians? J Family Med Prim Care 2015;4:45-52. [Crossref] [PubMed]
- Bani-Sadr F, Barange K, Daoud F, et al. Persistently normal alanine aminotransferase levels in HIV/HCV- coinfected patients: the role of steatosis. HIV Med 2009;10:417-21. [Crossref] [PubMed]
- Machado MV, Oliveira AG, Cortez-Pinto H. Hepatic steatosis in patients co infected with human immunodeficiency virus/hepatitis C virus: a meta- analysis of the risk factors. Hepatology 2010;52:71-8. [Crossref] [PubMed]
- Sterling RK, Smith PG, Brunt EM. Hepatic Steatosis in HIV: A Prospective Study in Patients without Viral Hepatitis, Diabetes, or Alcohol Abuse. J Clin Gastroenterol 2013;47:182-7. [Crossref] [PubMed]
- Vernon G, Baranova A, Younossi ZM. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults. Aliment Pharmacol Ther 2011;34:274-85. [Crossref] [PubMed]
- Han TM, Naicker S, Ramdial PK, et al. A cross-sectional study of HIV-seropositive patients with varying degrees of proteinuria in South Africa. Kidney Int 2006;69:2243-50. [Crossref] [PubMed]
- Wyatt CM, Klotman P. HIV-Associated Nephropathy in the Era of Antiretroviral Therapy. Am J Med 2007;120:488-92. [Crossref] [PubMed]
- Husain NE, Ahmed M, Almobarak A, et al. HIV-Associated Nephorpathy in Africa: Pathology, Clinical Presentation and Strategy for Prevention. J Clin Med Res 2018;10:1-8. [PubMed]
- Fabian J, Naicker S. HIV and kidney disease in sub-Saharan Africa. Nat Rev Nephrol 2009;5:591-8. [Crossref] [PubMed]
- Gerntholtz TE, Goetsch S, Katz I. HIV-related nephropathy: A South African perspective. Kidney Int 2006;69:1885-91. [Crossref] [PubMed]
- Arendse CG, Wearne N, Okpechi I, et al. The acute, the chronic and the news of HIV-related renal disease in Africa. Kidney Int 2010;78:239-45. [Crossref] [PubMed]
- Ibrahim F, Hamzah L, Jones R, et al. Baseline Kidney Function as Predictor of Mortality and Kidney Disease Progression in HIV-Positive Patients. Am J Kidney Dis 2012;60:539-47. [Crossref] [PubMed]
- Mulenga LB, Kruse G, Lakhi S, et al. Baseline renal insufficiency and risk of death among HIV-infected adults on antiretroviral therapy in Lusaka, Zambia. AIDS 2008;22:1821-7. [Crossref] [PubMed]
- Sinha U, Mukhopadhyay P, Sengupta N, et al. Human immunodeficiency virus endocrinopathy. Indian J Endocrinol Metab 2011;15:251. [Crossref] [PubMed]
- Ekpebegh CO, Ogbera AO, Longo-Mbenza B, et al. Basal Cortisol Levels and Correlates of Hypoadrenalism in Patients with Human Immunodeficiency Virus Infection. Med Princ Pract 2011;20:525-9. [Crossref] [PubMed]
- Odeniyi IA, Fasanmade O, Ajala M, et al. Adrenocortical Function in Nigerians With Human Immunodeficiency Virus. Ghana Med J 2013;47:171-7. [PubMed]
- Cournil A, Eymard-Duvernay S, Diouf A, et al. Reduced Quantitative Ultrasound Bone Mineral Density in HIV-Infected Patients on Antiretroviral Therapy in Senegal. PLoS One 2012;7. [PubMed]
- Ukibe NR, Ukibe S, Emelumadu O, et al. Impact of thyroid function abnormalities on reproductive hormones during menstrual cycle in premenopausal HIV infected females at NAUTH, Nnewi, Nigeria. PLoS One 2017;12:e0176361 [Crossref] [PubMed]
- Meya DB, Katabira E, Otim M, et al. Functional adrenal insufficiency among critically ill patients with human immunodeficiency virus in a resource-limited setting. Afr Health Sci 2007;7:101-7. [PubMed]
- Long LC, Fox M, Sauls C, et al. The High Cost of HIV-Positive Inpatient Care at an Urban Hospital in Johannesburg, South Africa. PLoS One 2016;11:e0148546 [Crossref] [PubMed]
石瑞紫
复旦大学公共卫生学院流行病与卫生统计学在读博士研究生,专业方向:艾滋病相关流行病学。(更新时间:2021/8/29)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Ahmed MH, Gooneratne S, Bondje S, Rawther F, Duku A, Mital D. HIV metabolic clinic: can the journey start from a UK clinic to a sub-Saharan African nation? J Public Health Emerg 2018;2:28.